Por Elisabet Salmerón
Una extraña euforia marcó el 5 de julio de 1996: nacía Dolly, el primer mamífero clonado. La oveja escocesa abrió la posibilidad de tratar enfermedades gracias al poder de las células madre embrionarias y despertó un controvertido debate ético con implicaciones legales. Hoy, 15 años después de Dolly, los escollos morales –no los técnicos– se salvan con la nueva técnica de reprogramación celular, mientras la medicina regenerativa sigue soñando con fabricar tejidos y órganos a medida.
Si existiera un paseo de la fama para animales, sin duda, la oveja Dolly tendría su estrella en él. Su clonación puso a prueba la confianza de los investigadores en el éxito de su trabajo hasta 277 veces, pero al fin su constancia obtuvo recompensa y un 5 de julio de hace 15 años nacía el primer mamífero clonado con células adultas, aquellas ya programadas para cumplir una misión en el organismo.
Con este logro se rompía la creencia de que la generación de un nuevo ser solo era posible con células embrionarias, todavía sin ‘etiquetar’. Sin embargo, casi siete años después, un cáncer de pulmón ponía fin, de manera prematura, a la historia de la oveja más famosa. ¿Se extinguían con ella las esperanzas?
"Dolly supuso un paso importante y exitoso y promovió el debate en la sociedad sobre algunos aspectos importantes de la biomedicina", declara a SINC Manuel Álvarez, investigador del Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER) de Sevilla. La clonación terapéutica fue uno de los temas que saltó sobre la mesa.
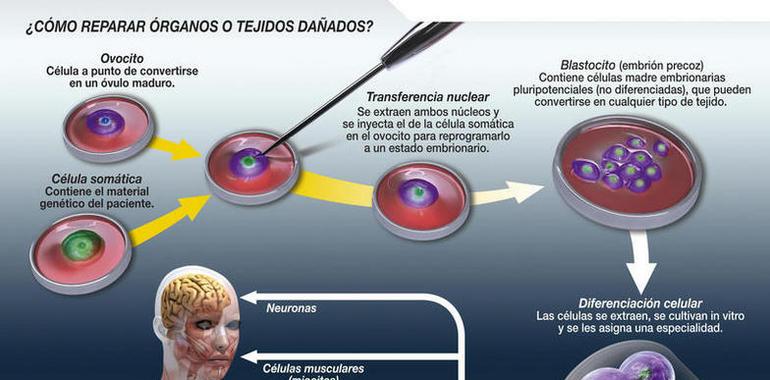
El objetivo de este tipo de clonación es obtener tejido para reparar un órgano dañado o tratar una enfermedad. Para ello, se aplica la técnica de la transferencia nuclear celular, la misma que se utilizó con Dolly. La fórmula requiere del núcleo de una célula somática –capaz de generar tejidos y órganos–, y un ovocito –óvulo inmaduro–. De su fusión se obtiene un embrión precoz –blastocito–, en cuyo interior se hallan células madre embrionarias pluripotentes que pueden diferenciarse para formar parte de cualquier tipo de tejido.
El proceso cerraría con el trasplante de dichas células a la zona dañada del organismo del paciente. El éxito de la operación estaría garantizado en al menos un aspecto: no habría opción de rechazo, ya que la célula somática contendría el ADN del paciente.
A la generación de estas nuevas células de sustitución, se unen, según Álvarez, otros dos mecanismos que explicarían la capacidad de las células madre para regenerarse: “La secreción de factores tróficos –proteínas que apoyan la supervivencia de las células– y la fusión celular entre célula madre y célula madura ‘defectuosa’, que llevaría a la mezcla de su genoma y permitiría revertir una mutación recesiva”, explica.
En la actualidad, esta técnica se reserva a los laboratorios ya que “el uso de células madre embrionarias puede inducir la aparición de tumores”, señala a SINC Lucía Núñez, investigadora del Instituto de Biología y Genética Molecular (IBGM) de la Universidad de Navarra y el Consejo Superior de Investigaciones Científicas.
Pero además de los escollos técnicos, “el principal defecto de la clonación humana con fines terapéuticos son las consecuencias éticas y legales“, remarca la científica, ya que la extracción de las células madre del interior del blastocito supone la destrucción del embrión, algo que no todos los sectores sociales aceptan. A pesar de ello, España se convirtió en 2007 en el cuarto país europeo que permitía la clonación terapéutica de embriones humanos y un año después, autorizaba el primer estudio con esta técnica.
Regreso al pasado celular
El nacimiento de Dolly no solo demostró que las células adultas de mamíferos pueden reprogramarse a un estado embrionario, sino también que "los óvulos contienen factores de reprogramación nuclear", declara a SINC Shinya Yamanaka, director del Centro de Investigación y Aplicación Celular IPS de la Universidad de Kioto (Japón).
Fueron estos factores los que le llevaron a encerrarse en el laboratorio hasta que en 2006 hizo público su gran éxito, la generación de células madre de pluripotencia inducida (IPS, por sus siglas en inglés) a partir de células adultas. Su logro robaba a las embrionarias la exclusiva capacidad de especializarse.
Para conseguirlo, el investigador nipón combinó cuatro factores de crecimiento (genes) y los introdujo en células de piel de ratones. El objetivo era hacer retroceder en el tiempo a las células adultas y convertirlas de nuevo en células madre que pudieran transformarse en cualquier tejido.
Tal ha sido la relevancia de las IPS que hasta el padre de Dolly, Ian Wilmut, investigador del Centro de Medicina Regenerativa de Edimburgo (Escocia), abandonó la transferencia nuclear para sumarse a la causa de Yamanaka al considerar que las IPS proporcionan “una manera más efectiva de estudiar las enfermedades humanas", según manifiesta a SINC.
En palabras de Manuel Álvarez, "la generación de IPS es una de las herramientas más importantes de los últimos años para estudiar mejor las enfermedades –sobre todo las patologías raras–, realizar cribados farmacológicos y hacer terapias celulares". Aunque, en su opinión, "no reemplazarán a otras fuentes celulares". El mismo punto de vista comparte Lucía Núñez, quien cree que la reprogramación celular resultará "más efectiva" que las células madre embrionarias, aunque se muestra escéptica en creer que esto se consiga pronto.
Ambas técnicas compiten por un mismo fin: tratar patologías hasta ahora incurables y facilitar la medicina regenerativa. Sin embargo, la metodología de Yamanaka también se enfrenta a retos de seguridad, porque las IPS corren el riesgo de volverse cancerígenas.
¿Qué futuro le depara a la biomedicina?
Echando la vista atrás, Manuel Álvarez reconoce que desde el nacimiento de Dolly hace 15 años "se ha avanzado mucho en biomedicina, pero no lo deseable". Por su parte, Wilmut no duda de un fructífero porvenir en los próximos años: "El futuro es muy excitante. En un plazo de 10 a 50 años tenemos la esperanza de desarrollar los primeros tratamientos efectivos para muchas enfermedades hereditarias", manifiesta.
Yamanaka, aunque más precavido que el investigador escocés, asegura que se está invirtiendo el máximo esfuerzo "para trasladar las IPS a los pacientes lo más rápido posible". Y, a pesar de no ser partidario de la clonación humana, reconoce que "la duplicación somática es prometedora a la hora de producir animales útiles para la humanidad".
En este caso, la atención se desvía hacia dos opciones: la fabricación íntegra de órganos, objetivo para el que Álvarez apuesta por una mezcla de “células clonadas de los pacientes sobre soporte derivado de órganos animales”. Y en segundo lugar, la creación de animales transgénicos a los que se inserta un gen que no les pertenece (transgén) para entender el papel que desempeñan en el desarrollo de una enfermedad.
En la actualidad, el recuerdo de Dolly aguarda recluido en una vitrina del Museo Real de Escocia en Edimburgo, pero su nacimiento puso en boca de todos las células madres. Desde entonces, la investigación de su potencial biomédico no cesa, mediante clonación o reprogramación, y, a pesar de ello, una pregunta sin respuesta ronda incesante el pensamiento de todos los científicos: ¿lograremos crear órganos a medida?
FOTO: Descripción del proceso de clonación terapéutica. Imagen: SINC / José Antonio Peñas