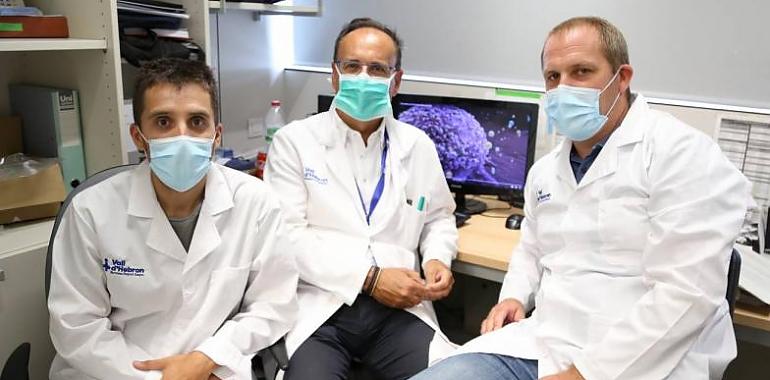
Investigadores del Vall d’Hebron Instituto de Investigación han descrito el papel de la integrina B3 en la comunicación entre células, clave para el desarrollo de metástasis en el cáncer de mama ya que favorece la diseminación del tumor en otros órganos, como el pulmón. foto: De izq. a dcha., los investigadores Pedro Fuentes, Santiago Ramón y Cajal y Stefan Hümmer. / CIBERONC
Un equipo del grupo de Patología Molecular Traslacional del Vall d’Hebron Instituto de Investigación (VHIR), en colaboración con el Centro de Investigación Biomédica en Red de Cáncer (CIBERONC) ha descrito el papel de la proteína integrina B3 (ITGB3) en la metástasis del cáncer de mama.
El estudio, publicado en Nature Communications, muestra la importancia de la integrina B3 en la captación de vesículas por parte de las células, lo cual favorece la formación de tumores secundarios en otros órganos como el pulmón. Así, esta proteína podría ser una diana terapéutica para evitar la formación de metástasis.
La integrina B3 es fundamental en la captación de vesículas por parte de las células, lo cual favorece la formación de tumores secundarios en otros órganos como el pulmón
Un 90 % de las muertes producidas por cáncer de mama son a causa de metástasis en otros órganos, como el pulmón. Para que estas metástasis se produzcan, la comunicación entre células tumorales y también con las células del sitio metastático es clave. Esta comunicación celular se basa en la producción de vesículas que son captadas por otras células y que contienen factores que ayudan a desarrollar las metástasis.
Sin embargo, el mecanismo que permite que esto suceda no se conoce en profundidad. “Es uno de los primeros estudios que describe las vías que permiten que estas vesículas entren en las células para favorecer el crecimiento tumoral y el papel que la integrina B3 posee en este proceso”, explica Stefan Hümmer, investigador del VHIR y el CIBERONC y uno de los autores del trabajo.
El estudio, llevado a cabo en cultivos celulares en el laboratorio, ha comprobado que la integrina B3, una proteína que sirve de conexión entre el exterior y el interior de la célula, es necesaria para que las vesículas producidas por el entorno sean captadas por las células tumorales.
“Hemos visto que, cuando inhibimos la integrina B3, las vesículas no se pueden interiorizar y, por lo tanto, no existe el estímulo que favorece el crecimiento tumoral en el nuevo órgano para formar metástasis”, comenta Santiago Ramón y Cajal, jefe del grupo de Patología Molecular Traslacional del VHIR y jefe de grupo del CIBERONC.
Búsqueda de inhibidores de la integrina B3
Este trabajo es la continuación de otros estudios previos donde se ha observado que la integrina B3 aumenta en situaciones de falta de oxígeno y favorece la migración celular y las metástasis. Tras esta publicación, el grupo está trabajando en la búsqueda de inhibidores de la integrina B3, lo cual sería una posible estrategia para evitar que las células formaran nuevas colonias en otros órganos, es decir, evitar las metástasis.
El grupo trabaja ahora en la búsqueda de inhibidores de la integrina B3, lo cual sería una posible estrategia para evitar las metástasis
Ramón y Cajal destaca que “estos inhibidores serían específicos para el control de las metástasis. Por ello, deberían administrarse conjuntamente con otros tratamientos dirigidos al tumor primario”.
Este mecanismo de entrada en las células, basado en la integrina B3, se ha podido observar con anterioridad en muchos virus herpes cuando infectan a células humanas. Estas similitudes han ayudado a los investigadores a conocer y estudiar la vía de entrada de las vesículas captadas por las células.
Referencia:
Pedro Fuentes, Marta Sesé, Pedro J. Guijarro, Marta Emperador, Sara Sánchez-Redondo, Héctor Peinado, Stefan Hümmer & Santiago Ramón y Cajal. ‘ITGB3-mediated uptake of small extracellular vesicles facilitates intercellular communication in breast cancer cells’. Nature Communications volume 11, Article number: 4261 (2020).