Hasta ahora se conocía sobre todo el papel de estas proteínas en el plegamiento de otras recién formadas
Un equipo del CSIC ha caracterizado estructuralmente el proceso que permite a las chaperonas cambiar de una función a otra
La flexibilidad de las chaperonas moleculares, un conjunto de proteínas presentes en todas las células, favorece que actúen en diferentes procesos. Por un lado, ayudan a que otras proteínas recién formadas adopten la estructura tridimensional adecuada para su funcionamiento (plegamiento), pero, por otro, contribuyen a su degradación, un proceso opuesto al anterior, pero también esencial a nivel celular. Un equipo dirigido por investigadores del Consejo Superior de Investigaciones Científicas (CSIC) ha caracterizado uno de los mecanismos que permiten a las chaperonas moleculares actuar en la degradación de proteínas.
Los investigadores, que publican sus resultados en la revista Scientific Reports, han podido observar al detalle estos complejos extremadamente flexibles, que son capaces de atrapar y marcar todo tipo de proteínas, las cuales son posteriormente degradadas o llevadas al sistema de reciclaje celular. “Hasta ahora, el mecanismo que permite a las chaperonas cambiar de una función a otra no estaba claro desde un punto de vista estructural. Gracias a una combinación de técnicas de vanguardia como la criomicroscopía electrónica y la espectrometría de masas con entrecruzamiento, hemos podido obtener una imagen con una resolución media de los complejos formados por la proteína CHIP y las chaperonas moleculares Hsp70 y Hsp90”, ha explicado el investigador del CSIC José María Valpuesta, que trabaja en el Centro Nacional de Biotecnología. Mientras que los complejos con Hsp70 o Hsp90 ayudan al plegamiento de proteínas, la incorporación de CHIP en este sistema actúa como llave para el cambio de función. “Estos nuevos complejos dirigen la proteína hacia su degradación”, añade Valpuesta.
Además del equipo del Centro Nacional de Biotecnología, en la investigación han participado científicos del Centro de Regulación Genómica de Barcelona. Lucía Quintana-Gallardo, Jaime Martín-Benito, Miguel Marcilla, Guadalupe Espadas, Eduard Sabidó, José María Valpuesta. The cochaperone CHIP marks Hsp70- and Hsp90-bound substrates for degradation through a very flexible mechanism. Scientific Reports. DOI: 10.1038/s41598-019- 41060-0
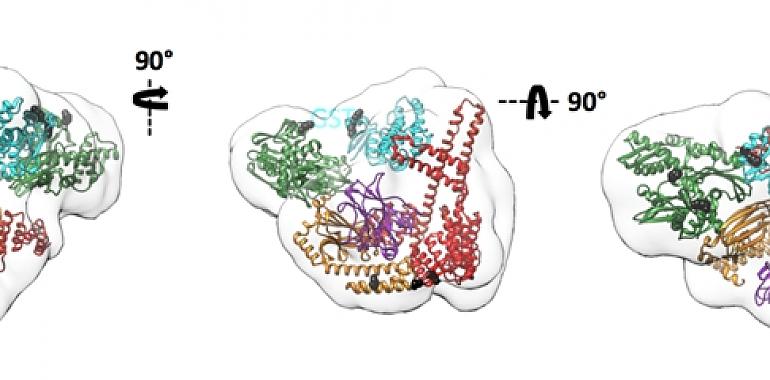
Foto: Tres vistas ortogonales (en blanco transparente), obtenidas por criomicroscopía electrónica, del complejo formado por la chaperona Hsp70, la proteína CHIP y el sustrato GST. En el interior del volumen se pueden observar las estructuras atómicas de la chaperona Hsp70 (en verde y naranja), la proteína CHIP (en rojo) y el sustrato GST (en cian)./ CSIC/ CNB