La Comisión Europea ha aprobado el uso de la formulación subcutánea (SC) de MabThera® (Rituximab) para el tratamiento de las clases de Linfoma No Hodgkin (LNH) más frecuentes. Tras la aprobación de Herceptin® SC en septiembre del pasado año, esta es la segunda vez que Europa autoriza el uso de la formulación subcutánea de un fármaco de Roche.
La nueva formulación subcutánea se administra en tan sólo cinco minutos frente a las dos horas y media que requiere la vía intravenosa.
Su uso en dosis fija reduce el tiempo de preparación y puede tener un impacto favorable en el gasto farmacéutico.
La directora médica y responsable del Desarrollo de Productos de Roche, Sandra Horning, manifestósu satisfacción por la aprobación obtenida. “Uno de nuestros objetivos es mejorar la vida de los pacientes y este tratamiento lo consigue, y además para uno de los tipos más comunes de LNH. La disponibilidad de la nueva formulación supone una administración del fármaco más rápida, en apenas cinco minutos, frente las dos horas y media de la vía intravenosa, con el beneficio que eso implica para los profesionales y sus pacientes”, comentó.
La aprobación europea se ha basado en los resultados del estudio SABRINA, que recientemente fueron publicados en la revista The Lancet Oncology.1Este estudio internacional fase III, en el que participaron once hospitales españoles, demostróque la formulación SC aporta los mismos beneficios farmacocinéticos que la administración por vía IV. Roche espera lanzar MabThera® SC en el mercado europeo durante este año.
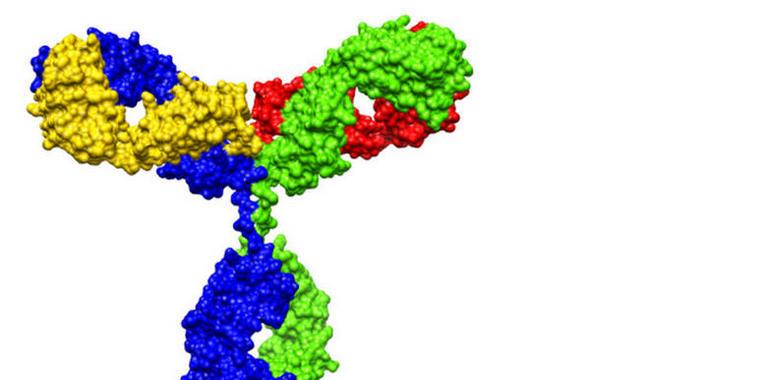
MabThera® (Rituximab) es un anticuerpo monoclonal que se une a una proteína específica, el antígeno CD20, que se encuentra en la superficie de los linfocitos B. Tras la unión, se movilizan las defensas naturales del organismo, lo que desemboca en la destrucción de los linfocitos B. Dado que las células madre -progenitoras de los linfocitos B- de la médula ósea no tienen antígeno CD20, los linfocitos B sanos pueden regenerarse después del tratamiento y alcanzar concentraciones normales en el transcurso de algunos meses.
El anticuerpo monoclonal, descubierto por Biogen Idec., recibióla primera autorización de la FDA en noviembre de 1997, como tratamiento en monoterapia para el Linfoma folicular, CD-positivo, refractario o en recaída. La Unión Europea concediósu aprobación en junio de 1998 y desde entonces más de dos millones y medio de pacientes han sido tratados con este medicamento, en la mayor parte de los casos como abordaje de tumores hematológicos, y sigue siendo estudiado en otros tipos de cáncer y enfermedades donde las células CD-positivo están implicadas.